Нильс Бор впервые показал, что электрон делает квантовые скачки по орбитам в атоме, и это изменило наше понимание микромира 
Фото: https://www.studenterforeningen.dk
Модель атома Бора пришла на смену планетарной модели атома Эрнеста Резерфорда.
108 лет назад датский физик-теоретик Нильс Бор предложил свою теорию строения атома, где электроны не подчиняются законам классической физики. В боровской модели атома электроны могут находиться только на разрешенных орбитах и способны мгновенно перескакивать между орбитами при поглощении и испускании фотонов (совершать квантовые скачки).
Ранее, летом 1912 года, ученый прислал своему наставнику Эрнесту Резерфорду черновик статьи, посвященной проблеме устойчивости атома. По сути, Нильс Бор впервые смог объяснить, почему электроны не падают на ядро атома: когда электроны движутся с ускорением по строго стационарным орбитам, они не излучают электромагнитных волн, а значит, не теряют энергию и не сходят с орбиты. Чтобы найти радиусы устойчивых орбит, пришлось обращаться к новой на тот момент, квантовой теории Макса Планка.
Справка. Состояние атома, в котором все электроны находятся на стационарных орбитах с наименьшей возможной энергией, называется основным, а все другие состояния — возбужденными. Стационарным состояниям соответствуют определенные стационарные орбиты, по которым движутся электроны.
Бором были сформулированы квантовые постулаты, которые резко расходились с классической механикой и классической электродинамикой, однако успешно позволяли описать простейший атом водорода. Нильс Бор впервые показал, что электрон делает квантовые скачки по орбитам в атоме, и это изменило наше понимание микромира.
Кроме того, Бор ввел понятие об атомном номере, понял, что такое изотопы, высказал и осмыслил закон радиоактивного смещения. Он также внес огромный вклад в понимание некоторых процессов, происходящих внутри тяжелых атомных ядер, что имело решающее значение для начала исследований, приведших к освобождению ядерной энергии. (© «Нильс Бор. Жизнь и творчество», изд-во «Наука», 1967 г.).
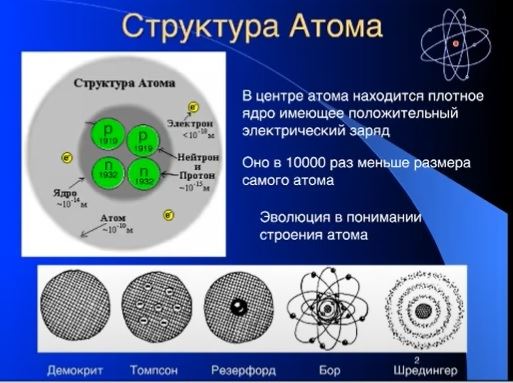
Фото: из презентации физика-теоретика Д.И. Казакова.
Согласно теории Бора, электрон вращается вокруг атома по строго стационарным орбитам. Бор ввел понятие квантового соотношения между радиусом орбиты и скоростью электрона.
«Исходным пунктом атомной теории Бора является признание того факта, что модель атома Резерфорда вместе с классической физикой не могут объяснить той устойчивости, которой, как мы знаем из нашего повседневного опыта, обладают атомы. <...> Исходя из нового положения Бора о существовании атома только в стационарных состояниях, теперь можно было описать эти состояния без какой-либо ссылки на такие классические представления, как электронные орбиты», — писали о вкладе Бора в развитие физики Х. Меллер и М. Пиль.
Теория датского физика объяснила не только стабильность атомов, но и линейчатый характер спектров — еще один важнейший вопрос физики того времени.
Орбитальная модель атома Бора, позже усовершенствованная Арнольдом Зоммерфельдом, стала итогом старой квантовой теории. Рождение новой квантовой теории состоялось в 1925—1926 годах и связано оно было с учеником Нильса Бора — Вернером Гейзенбергом (и его матричной механикой), а также с Эрвином Шредингером и Полем Дираком.
«Решающим моментом в атомной модели Резерфорда было то, что она со всей ясностью показала, что устойчивость атомов нельзя объяснить на основе классической физики и что квантовый постулат — единственно возможный выход из острой дилеммы, и эта острота несоответствия заставила меня абсолютно поверить в правильность квантового постулата», — говорил сам Нильс Бор.
В июле 1913 года в одном из старейших научных журналов Великобритании — Philosophical Magazine — вышла знаменитая статья Бора, посвященная строению атомов и молекул. Эта публикация имела фундаментальное значение для развития теоретической физики.
Источник: scientificrussia.ru




